Por que a água estraga os eletrônicos, mas o álcool geralmente não?
A água conduz eletricidade melhor do que o álcool e, portanto, causa curto-circuitos. Além disso, a água corrói os metais, enquanto os álcoois não. A água leva mais tempo para evaporar do que os álcoois.
Você se lembra daquela vez em que estava curtindoseu smartphone com uma xícara de chá para estimulação intelectual quando o telefone escorregou e caiu na xícara, destruindo efetivamente ambos?
A sabedoria convencional dita que líquidos e eletrônicos não combinam, mas você sabe exatamente o que o chá fez com seu telefone? Além disso, se o álcool tivesse substituído aquele chá, o resultado teria sido o mesmo?A água conduz eletricidade melhor do que o álcool e, portanto, causa curto-circuitos. Além disso, a água corrói os metais, enquanto os álcoois não. A água leva mais tempo para evaporar do que os álcoois.A resposta é explicada pelas diferenças nas propriedades químicas e físicas da água e do álcool.
Química da água
Uma molécula de água tem dois átomos de hidrogênio ligados a um átomo de oxigênio, denotado pela fórmula química H2O. O oxigênio e o hidrogênio formam uma ligação compartilhando um par de elétrons, com cada elétron do par sendo doado pelo hidrogênio e pelo oxigênio, respectivamente. Isso é chamado deligação covalente. Uma consequência do compartilhamento de elétrons é que não há elétrons livres para conduzir eletricidade. Na verdade, a água desionizada pura não conduz eletricidade.
O oxigênio tem uma propriedade incrível de atrair elétrons para si mais do que o hidrogênio (eletronegatividade). Em uma molécula de água, o par de elétrons está mais fortemente ligado ao oxigênio e ao hidrogênio. Assim, uma carga parcial negativa se desenvolve em átomos de O e uma carga parcial positiva se desenvolve em átomos de H. A geometria das moléculas de água é tal que há uma separação de cargas (os centros de cargas positivas e negativas não coincidem).
Uma molécula pode ter elementos com eletronegatividades diferentes e ainda ser apolar, como o metano, CH4. Isso torna a água uma molécula polar (com pólos de cargas opostas). Devido a isso, minerais como Ca2+, Mg2+, Na+, Cl–etc.são dissolvidos(o pólo negativo da molécula de água atrai os íons minerais carregados positivamente e vice-versa). Esses íons podem conduzir eletricidade na presença de umadiferença de potencial.
Além disso, a ligação intermolecular é forte na água devido à ligação de hidrogênio intermolecular. Esta é a razão para o alto ponto de ebulição da água, em comparação com os álcoois.
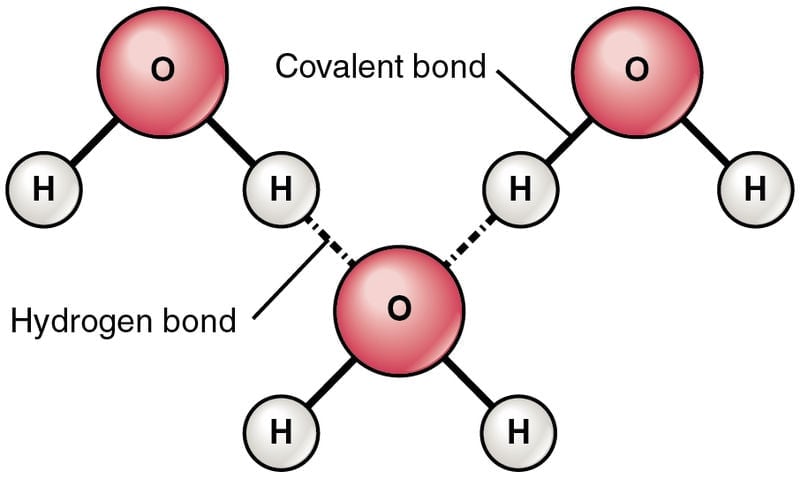
Fórmula estrutural de moléculas de água mostrando as ligações covalentes e de hidrogênio (Crédito da foto: OpenStax College
/Wikimedia commons)
Química do álcool
Na linguagem comum, o álcool refere-se ao licor ou ao líquido para fins médicos. No entanto, na ciência, o álcool não é um único líquido, mas uma classe de compostos orgânicos (ou seja, contendo carbono) que possuem ogrupo funcional(-OH). Um grupo funcional é uma coleção de átomos, de modo que algumas propriedades distintas estão associadas ao composto orgânico ligado a ele.
Como no caso da água, as ligações formadas entre os elementos são ligações covalentes (compartilhamento de elétrons). Isso se traduz em uma falta de elétrons e íons livres para conduzir eletricidade. Assim, o álcool puro também é um isolante.
Dissolver íons minerais em álcool torna-se mais difícil do que dissolvê-los em água, pois existe impedimento estérico (dificuldade em acomodar novas espécies devido à repulsão de espécies existentes) entre a cadeia carbônica e os íons minerais; a magnitude da carga também é menor em álcoois.
Uma vez que o O altamente eletronegativo está ligado em uma extremidade, ele atrai pares de elétrons para si, ganhando uma carga parcial negativa e dando uma carga parcial positiva a outros átomos. Os álcoois podem ser visualizados como tendo uma extremidade polar (-OH) e uma extremidade apolar (cadeia de carbono). Isso torna o álcool um composto anfifílico (adequado para ligação com compostos polares e não polares), que tem aplicações tanto na limpeza quanto na desinfecção.
Além disso, a atração intermolecular nos álcoois é mais fraca do que na água (impedimento estérico causado pela presença de uma cadeia de carbono volumosa). Assim, émais fácil vaporizar o álcool do que a água.
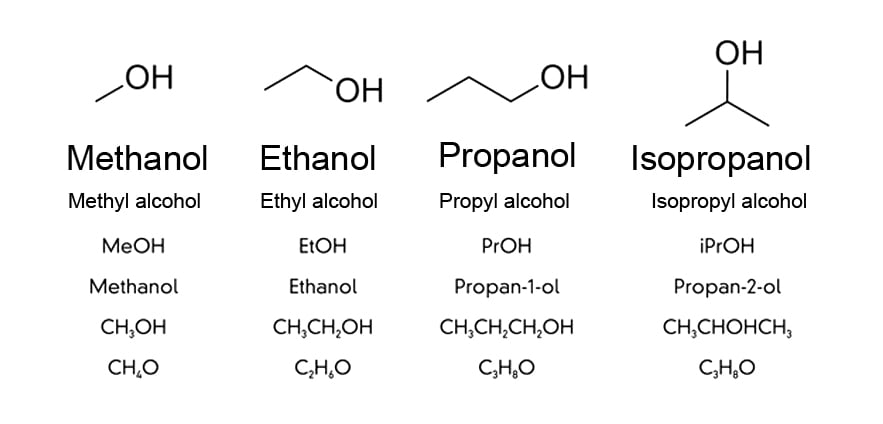
As varetas denotam cadeias de carbono e -OH é o grupo funcional (Crédito da foto: Peter Hermes Furian/Shutterstock)
Efeito da água em eletrônicos
As consequências do contato da água com a eletrônica podem ser divididas em duas partes: efeitos de curto e longo prazo.
Como a água contém íons minerais dissolvidos, ela é capaz de conduzir eletricidade. Quando um dispositivo ligado entra em contato com água, vários terminais dentro do dispositivo entram em contato com o mesmo condutor, ou seja, água. Um caminho alternativo para o fluxo de corrente é criado e a eletricidade começa a fluir em direções onde não deveria. Isso é chamado de curto-circuito. Durante um curto-circuito, uma grande quantidade de fluxo de corrente ocorre em um curto espaço de tempo, resultando em aquecimento excessivo e, nos piores casos, incêndio!
Como a maioria dos dispositivos utiliza baterias CC como fonte de energia, a água que entra em contato com o ânodo e o cátodo da bateria levaria à eletrólise com a evolução dos gases inflamáveis H2e O2 .
A água também contém moléculas de oxigênio dissolvido (O2 ).Todos os eletrônicos contêm PCBs (placas de circuito impresso). PCBs têm metais como cobre, ouro e paládio como condutores. Quando exposto à água, ocorre umareação redox onde ometalperde elétrons e forma uma camada de óxido metálico. Com o tempo, isso resulta na diminuição do volume de metal condutor no terminal (decomposição). Em casos extremos, o metal torna-se estruturalmente fraco e quebra.
As telas de exibição de LED/LCD contêm um painel de luz de fundo que fornece iluminação. Quando a água entra no painel de luz de fundo, ocorre a refração inadequada da luz e a exibição resultante fica distorcida (aparência nebulosa, manchas pretas, etc.).

Semicondutoresdanificados por corrosão (Crédito da foto: Binarysequence/Wikimedia commons)
Além disso, as moléculas de água podem bloquear os alto-falantes, resultando em uma saída abafada.
Efeito do álcool em eletrônicos
Os álcoois não contêm impurezas iônicas dissolvidas em concentrações tão altas quanto as encontradas na água. Quando o álcool entra em contato com eletrônicos, a falta de espécies carregadas livres (íons e elétrons livres) resulta em nenhum efeito na condutividade. Assim, o curto-circuito não ocorre.
Como o álcool evapora mais rápido que a água, a possibilidade de o álcool permanecer por tempo suficiente para causar danos aos componentes eletrônicos é eliminada. Assim, a probabilidade de a tela e os alto-falantes serem arruinados é diminuída.
Além disso, como o álcool pode se ligar a compostos polares e não polares, o álcool se liga às membranas das células gordurosas de germes lipofílicos e também desnatura as proteínas nos micróbios, matando-os efetivamente. Assim, álcoois (especialmente álcool isopropílico, IPA)são frequentemente usadoscomo agentes de limpeza.

O álcool isopropílico é um agente de limpeza amplamente utilizado (Crédito da foto: twenty20)
Quando os álcoois jogam Spoilsport
Há casos, no entanto, de álcoois arruinando eletrônicos. Oponto de fulgor(temperatura mais baixa na qual o composto forma vapores que são combustíveis na presença de uma fonte de ignição como o oxigênio) dos álcoois determina o risco de inflamabilidade. Se a temperatura do dispositivo subir acima do ponto de fulgor, o contato do álcool pode ser bastante desagradável (o álcool forma vapores que podem inflamar). Assim, os álcoois devem ser usados apenas quando o aparelho estiver desligado e frio.
Se o álcool entrar em contato com o ânodo e o cátodo da bateria, ele pode ser eletrolisado, liberando gás H2, que é inflamável emconcentrações tão baixas quanto 4% (v/v)no ar.
Álcoois de baixo peso molecular como etanol e álcool isopropílico (IPA) podem dissolver quantidades muito pequenas de impurezas iônicas. Se houver um volume suficiente de álcool (por exemplo, mergulhar o dispositivo em um banho de álcool), pode ocorrer um curto-circuito.
Uma palavra final
A discussão acima girou principalmente em torno da água potável e do álcool de baixo peso molecular (etanol, álcool isopropílico, etc.). Água pura e álcool puro raramente danificam eletrônicos, mas impurezas dissolvidas e ligações intermoleculares são os principais culpados quando as coisas dão errado! Basicamente, como a água pode dissolver mais impurezas e evaporar mais lentamente do que os álcoois, ela tende a arruinar os eletrônicos mais facilmente do que os álcoois.