O dióxido de carbono (CO2) é polar ou não polar?
O dióxido de carbono (CO2) não é polar porque tem uma estrutura linear e simétrica, com 2 átomos de oxigênio de igualdade de elétrongatividade que puxa a densidade eletrônica do carbono em um ângulo de 180 graus de qualquer direção. A polaridade em uma molécula ocorre devido à partilha desigual de elétrons de valência; uma vez que não há compartilhamento desigual de elétrons de valência no caso do dióxido de carbono, é não-polar.No entanto, antes de chegar ao final disso, ajuda a entender alguns conceitos subjacentes em relação à polaridade de uma molécula.
O que é polaridade?
Moléculas que têm regiões de carga positiva e negativa são referidas como “polares”, e essa propriedade de tais moléculas é chamada de polaridade.
Tome água, por exemplo. Devido à sua estrutura dobrada e ao tipo de ligações que possui, uma extremidade de sua molécula (ou seja, a extremidade do oxigênio) possui uma ligeira carga negativa, enquanto a outra extremidade possui uma ligeira carga positiva (ou seja, a extremidade do hidrogênio). Isso torna a água uma molécula polar.
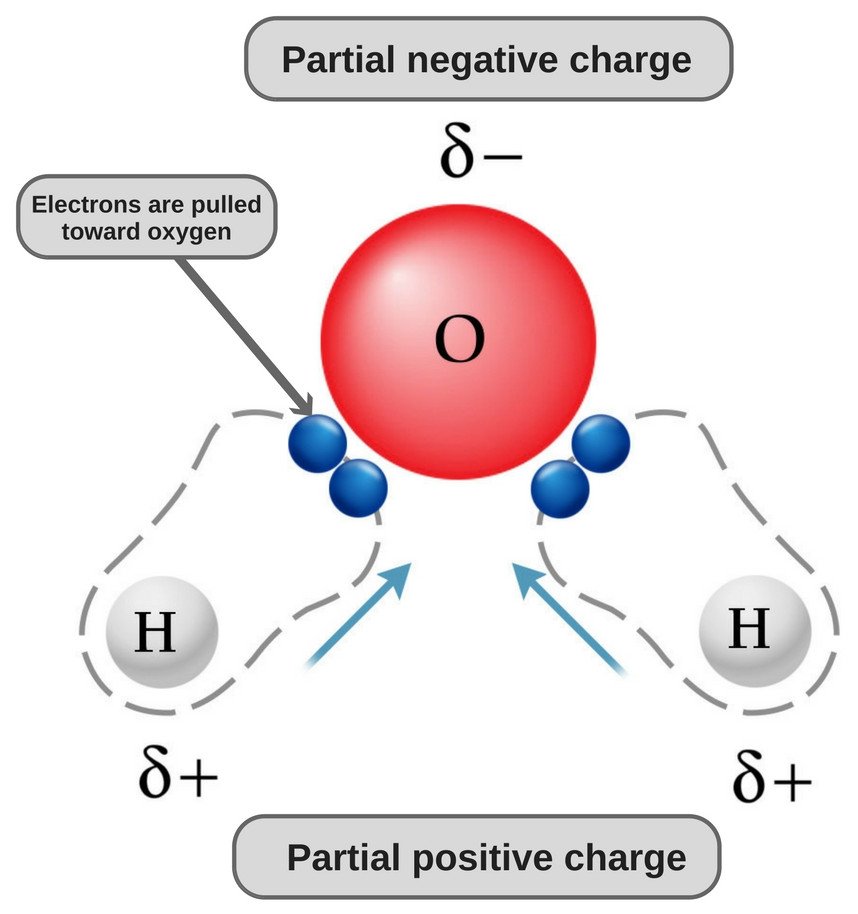 Da mesma forma, moléculas que não possuem regiões de carga positiva e negativa são referidas como não-polares. O etano, por exemplo, é uma molécula não polar. A forma que possui e o tipo de ligações que consiste em deixá-lo sem regiões de carga.
Da mesma forma, moléculas que não possuem regiões de carga positiva e negativa são referidas como não-polares. O etano, por exemplo, é uma molécula não polar. A forma que possui e o tipo de ligações que consiste em deixá-lo sem regiões de carga.
Há uma noção em química que diz que “gosta dissolve gosta”; Esta é realmente uma referência à solubilidade de uma substância em outra. Os materiais polares tendem a ser mais solúveis em solventes polares, e o mesmo é verdadeiro para materiais não-polares.
O que torna uma molécula polar?
A polaridade de uma molécula está relacionada ao deslocamento de elétrons em uma direção particular. Isso, por sua vez, depende da polaridade dos laços presentes na molécula, pois esses vínculos também contêm elétrons.
O vínculo entre dois átomos é dito ser polar se ambos os átomos forem diferentes, porque se ambos os átomos forem os mesmos, então os núcleos de ambos os átomos se manterão em seus elétrons e, conseqüentemente, esses elétrons não poderão mudar qualquer direção. Por outro lado, se os dois átomos forem diferentes, eles definitivamente terão poderes diferentes para atrair os elétrons da ligação.
Assim, o átomo com o poder superior para atrair elétrons para si mesmo (ou seja, é mais eletronegativo do que o outro átomo), adquirirá uma ligeira carga negativa sobre si mesmo, e a ligação entre os dois átomos se tornará polar.
Em suma, você poderia dizer que a densidade de elétrons de uma ligação polar se acumula em direção a uma extremidade da ligação, o que resulta que esse fim possui uma ligeira carga negativa, enquanto a outra extremidade possui uma ligeira carga positiva. Isso torna uma molécula polar. Do mesmo modo, se uma molécula não possui regiões de carga positiva e negativa, é considerado não-polar.
No entanto, uma coisa interessante a notar é que quanto maior a diferença de electronegatividade, mais polar será a ligação dentro de uma molécula. Os compostos de carbonilo são polares porque o carbono carbonílico é ligeiramente positivo. Então, não deveria o dióxido de carbono, que contém um carbono positivo e dois oxigénios parcialmente negativos, ser polar?
Por que o dióxido de carbono não é polar?
Se uma molécula é constituída por mais de uma ligação, então o efeito combinado de todas essas ligações deve ser considerado. Vejamos a estrutura do dióxido de carbono:
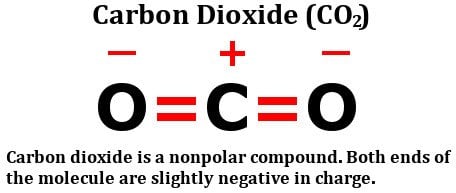
Como você pode ver claramente, a molécula tem um átomo de carbono compartilhando duas ligações duplas com oxigênio. Com certeza, o oxigênio é mais eletronegativo do que o carbono, então, pode-se pensar que os elétrons presentes na ligação entre o carbono e o oxigênio seriam puxados para o átomo de oxigênio.
No entanto, isso realmente não acontece. A razão está na geometria da molécula. Como você pode ver, essas duas ligações duplas estão a 180 graus do átomo de carbono central. Portanto, como o átomo de oxigênio à direita tenta puxar a densidade de elétrons do carbono sobre si mesmo, o (outro) átomo de oxigênio, ou seja, o do lado esquerdo, puxa a densidade de elétrons sobre si mesmo com a mesma força.
O resultado é que não há deslocamento líquido de elétrons em qualquer direção, portanto, não há acumulação de carga líquida em nenhum dos átomos, tornando a molécula de dióxido de carbono não polar.
Referências
- Harper College
- Penn State University
- Universidade de Wisconsin-Madison
- Universidade de Illinois
- Instituto de Tecnologia de Massachusetts