Por que os dedos / mãos se prendem ao gelo?

Você provavelmente já notou que, enquanto toma um gelado recipiente frio fora do congelador, seus dedos tendem a ficar com o gelo; Não só no recipiente em si, mas também para os depósitos de gelo que se formam quando você não descongelou seu freezer em um tempo.
Por que nossas mãos decidem ser pegajosas quando entram em contato com o gelo?

Fatores que afetam a adesão entre a pele e o gelo.
Gelo tende a manter a nossa pele, mas nem sempre tem essa atração incomum. Se ou não um pedaço de gelo vai ficar com a nossa pele depende de dois fatores importantes: umidade da parte do corpo (que está em contato com o gelo) ea temperatura do gelo.
Umidade em suas mãos.
A maioria de nós sempre tem um pouco de água em nossas mãos, braços, pernas, etc na forma de umidade, se ou não percebemos isso. Sua língua, por exemplo, permanece molhada o tempo todo devido à saliva em nossa boca, por isso também se torna um candidato muito bom para aderir ao gelo.
Temperatura do gelo.

Fonte da imagem: Wikipedia.org
Estamos falando de “gelo” aqui, por isso é lógico que ele deve estar em 0 graus Celsius (32 graus Fahrenheit), ou seja, a temperatura de congelamento da água. No entanto, isso pode não ser necessariamente assim em todos os casos. Embora a água não congelar a 0 graus Celsius, a temperatura do pedaço de gelo em questão (incluindo os cubos de gelo que você tirar do congelador) pode ser ainda menor do que 0 graus Celsius. Depois de tirar os cubos de gelo do congelador e mantê-los fora (à temperatura ambiente) por algum tempo, eles começam a descongelar, o que significa que sua temperatura começa a subir.
O takeaway principal aqui é que o gelo mais frio é, mais tende a furar a sua mão ou a qualquer outra parte de corpo exposta.
Papel dos átomos de hidrogênio e oxigênio.
Agora que você sabe os dois fatores essenciais necessários para aderir gelo à pele, vamos ver como o processo realmente ocorre.
Em sua forma líquida, as moléculas de água podem romper as conexões com suas outras moléculas e formar novas instantaneamente, concedendo à água a capacidade de fluir facilmente. No entanto, quando se trata de gelo, estas moléculas são presas no lugar devido à temperatura fria. A estrutura do gelo, se você pensar nisso, faz com que algumas moléculas de água (que consistem em átomos de hidrogênio e oxigênio) se alinham ao longo da superfície voltada para fora.
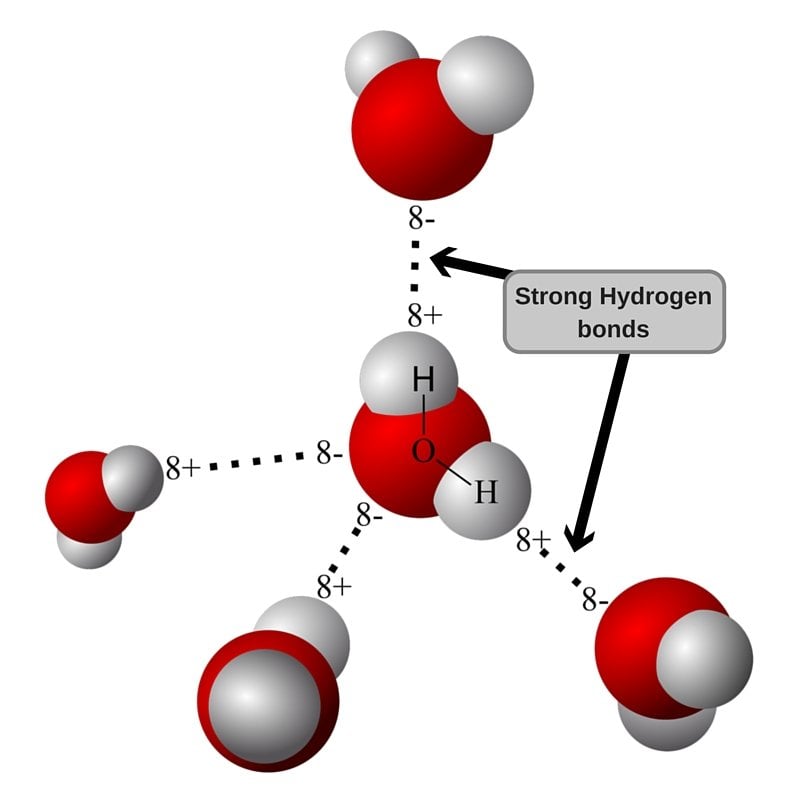
Forte ligações de hidrogénio presentes numa molécula de água
Os átomos de oxigênio presentes ainda querem formar ligações de hidrogênio com átomos de hidrogênio em suas moléculas de água companheiro. Mas infelizmente … eles não podem, pois eles estão na superfície e, portanto, destinada a ficar longe das moléculas de água que podem se ligar com eles.
Este é o lugar onde a água presente em sua mão na forma de umidade vem para o resgate. Os átomos de oxigênio e hidrogênio presentes nas moléculas de água na superfície ligam-se a átomos de hidrogênio e oxigênio, respectivamente, que estão presentes na umidade de sua mão, resultando em ligações de hidrogênio múltiplas.
E há uma coisa que você deve saber sobre ligações de hidrogênio …
Isto é o que faz com que a sua mão para manter o gelo. Quanto mais frio o gelo, mais forte é a aderência entre os dois. No entanto, isso pode ser facilmente desfeito, despejando um pouco de água quente sobre o ponto de contato.
Portanto, quando você estiver em um laboratório conduzindo um experimento que envolve gelo, você seria sábio para manter seus dedos enluvados e sua língua com segurança dentro de sua boca.