Por que as bolhas se formam em um copo de água que é deixado de fora?
Encha um copo com água (a temperatura ambiente ou abaixo dela) e deixe-o inalterado por algumas horas (você pode fazer isso usando água da torneira). Você notará eventualmente que as bolhas muito pequenas começam a aparecer ao longo do lado do vidro (no interior). Por que isso acontece?
Por que as bolhas se formam em um copo cheio de água que é deixado de fora durante a noite?
Resposta curta:A água que sai da torneira contém gases atmosféricos, como nitrogênio e oxigênio, dissolvidos nele. Como o vidro cheio de água senta-se por algumas horas, sua temperatura sobe ligeiramente (a água fica mais quente), o que faz com que os gases dissolvidos nele para sair da água e formar bolhas ao longo do interior do vidro.
Solubilidade dos gases na água.
A água que sai de torneiras e torneiras viaja através de tubos antes de alcançar grandes tanques de armazenamento. É por isso que a água está em uma pressão maior do que o normal (enquanto nos tubos), e também é mais frio. Estas duas condições são ideais para que dissolva determinados gases que são encontrados abundante em nossa atmosfera, incluindo o nitrogênio eo oxigênio.
Os gases são mais solúveis em água a temperaturas mais frias.
Gases, em geral, são mais solúveis em água quando está em uma temperatura mais baixa. Em outras palavras, você pode dizer que a solubilidade dos gases na água diminui à medida que a temperatura da água aumenta. O gráfico abaixo deve ajudar a visualizar como a solubilidade dos gases varia com a mudança de temperatura.
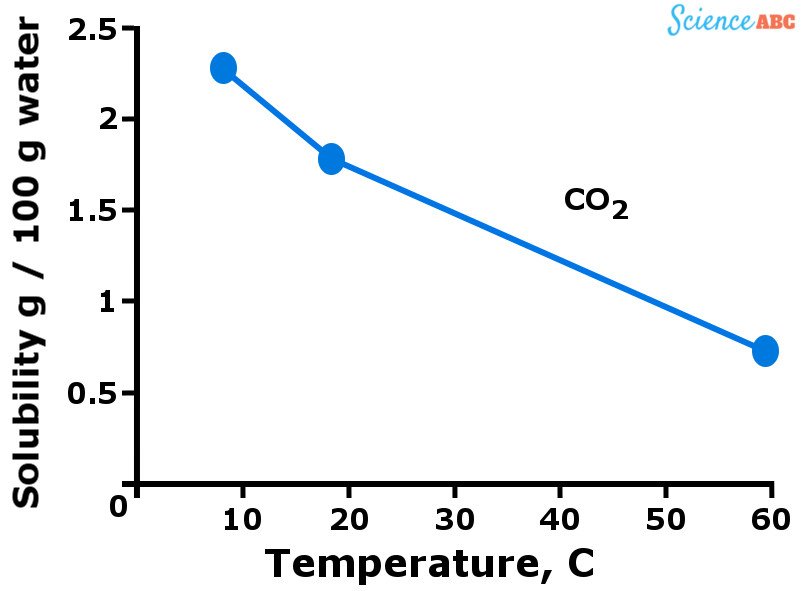
A variação da solubilidade do dióxido de carbono na água com o aumento da temperatura
A tendência descendente da solubilidade dos gases com o aumento da temperatura é bastante semelhante à forma como a pressão de vapor aumenta com a temperatura. Você vê, mais moléculas de gás são dissolvidos em água quando está frio. No entanto, quando a água começa a ficar mais quente (ou seja, a temperatura sobe), a energia cinética das moléculas de gás também aumenta.
Isso permite que essas moléculas se movam mais livremente e romper as ligações intermoleculares que mantê-los juntos, escapando assim da solução. É por isso que a solubilidade dos gases diminui à medida que a temperatura aumenta.
Perigo para a vida aquática devido à alteração da temperatura da água.
A dependência da temperatura da solubilidade dos gases da água tem uma implicação direta na vida de criaturas aquáticas. Você vê, criaturas aquáticas como os peixes precisam de oxigênio para a sobrevivência, e eles obtê-lo da água que vivem por absorver o oxigênio dissolvido (na água) através de suas brânquias. Dado que o oxigênio é mais solúvel em águas mais frias, é crucial que a temperatura não sobe além de um certo limite.

Resíduos de produtos liberados pelas usinas aumentam a temperatura da água, pondo em risco a vida marinha (Crédito da foto: Flickr)
No entanto, isso é exatamente o que está acontecendo nos dias de hoje, em grande parte devido às atividades humanas. As usinas de energia, por exemplo, descarregam enormes volumes de água quente em grandes corpos de água, o que aumenta a temperatura da água e drasticamente afeta a vida aquática. Esse é um resultado muito indesejável da dependência da temperatura da solubilidade do gás.
A solubilidade dos gases na água aumenta com o aumento da pressão.
Embora líquidos e sólidos não exibam praticamentenenhumaalteração de solubilidade com uma mudança na pressão da água, os gases o fazem. Observou-se que os gases são mais solúveis em água a pressões mais elevadas. Bebidas carbonatadas são excelentes exemplos desse fenômeno.
Lei de Henry
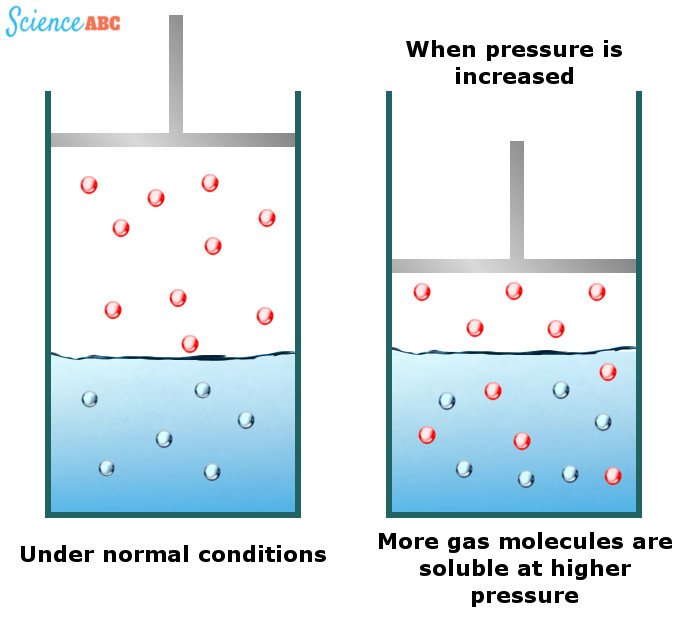
Os efeitos da mudança da pressão da água sobre a solubilidade dos gases podem ser explicados por uma das leis de gás conhecida como lei de Henry. Afirma que “a quantidade de gás dissolvido é proporcional à sua pressão parcial na fase gasosa”
A maneira mais simples de explicar essa dependência é que, à medida que a pressão aumenta, as moléculas de gás são forçadas para dentro da solução, de modo que a pressão aplicada pode ser aliviada. A imagem a seguir deve ajudar a visualizar isso melhor:
Bolhas formam em um copo cheio de água durante a noite.
Devido aos dois fenômenos físicos que discutimos acima, a água da torneira torna-se um bom candidato (se não ideal) para manter os gases atmosféricos dissolvidos. No entanto, quando aquela água é derramada num copo e deixada durante algumas horas à temperatura ambiente, a sua pressão começa a diminuir, enquanto a sua temperatura começa a subir.

Minúsculas bolhas formam em um copo de água durante a noite (Crédito da foto: Pixabay)
Isso faz com que os gases dissolvidos na água saem da solução e formam bolhas nos pontos ásperos no interior do vidro. Uma vez que o deslocamento da temperatura não é tão rápido (o que significa que a água não vai de gelada para searing quente em poucos minutos), leva algumas horas antes de as bolhas começam a aparecer no vidro.
Referências:
- A lei de Henry –Wikipedia
- Solubilidade –Departamento de Química (Florida State University)
- Temperatura Solubilidade em Gases –Antoine (Frostburg State University)
- Física Hyper
- Scientific American